Открытие периодического закона Менделеева: дата и суть
Дмитрий Иванович Менделеев – один из самых величайших российских ученых 19-го - начала 20-го века. Он известен как автор периодического закона, который оказал значительное воздействие на процветание множества наук и образования. Менделеев является автором работ не только по химии, но и физике, метрологии, метеорологии, экономике, воздухоплаванию, сельскому хозяйству и др. Так в каком году Менделеев открыл периодический закон?

Предпосылки открытия закона
В фундаменте собственных работ по систематизации химических элементов Менделеев разместил два ведущих и неизменных признака: атомная масса и свойства элементов. Он расписал на листах все имеющиеся знания об открытых и изученных химических элементах и их соединениях. Сравнивая эти данные, ученый создал естественные ряды химических элементов, похожих по своим свойствам. Сравнение этих элементов друг с другом дало понять, что элементы несхожих групп имеют общие свойства.
Таким образом, Менделеев объединил получившиеся группы химических элементов в одну систему. Объединение позволило обнаружить, что свойства элементов меняются в пределах явных совокупностей линейно (возрастание либо убывание). Вслед за тем время от времени совпадают, то есть через определенное количество элементов появляются похожие.
Химик выявил периоды, где свойства химических элементов и веществ, которые получились из них, подвергаются неизбежному изменению.
Основываясь на этих данных, Менделеев открыл периодический закон, который в соответствии с имеющейся в данный момент терминологией описывается так: «Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от их относительных атомных масс».

Когда появился периодический закон
Открытие периодического закона Менделеевым произошло предположительно 1 марта 1869 г.
Периодический закон и периодическая система элементов химии имеют повторяющуюся неслучайность: кроме известной периодичности по горизонтали (период) имеется также периодичность по вертикали (группа) и по диагонали. В связи с учетом всех этих видов Д. И. Менделеев смог не только предугадать, расписать свойства веществ, которые являлись не открытыми элементами, но и показать ход их появления, земные ресурсы (руда и соединения), из которых были выявлены простейшие вещества.
Суть открытия периодического закона Менделеева заключается в росте атомного веса химических элементов, из-за которого изменения свойств происходят не размеренно, а время от времени.

Публикация периодической таблицы
Менделеев разместил периодическую таблицу всех найденных на тот момент элементов в российском журнале и открыл некоторые новые элементы для завершения таблицы. При появлении системы элементов в немецком журнале Менделеев заявил:
- При расположении элементов в таблице в соответствии с их атомной массой проявляется видимая периодичность свойств.
- Элементы, которые сходны химическими свойствами, имеют атомный вес, который либо имеет почти одинаковое значение (пример: платина Pt, иридий Ir, осмий Os), либо постоянно увеличивается (пример: калий K, рубидий Rb, цезий Cs).
- Элементы или группы элементов расположены в таблице в соответствии с их атомными массами и их валентностями, а также их характерными химическими свойствами. Это можно отследить в ряду: Li - литий, Be - берилий, B - бор, C - углерод, N - азот, O - кислород, F - фтор.
- У наиболее рассеянных элементов имеется наименьший атомный вес.
- Характер элемента зависит от величины атомного веса, так же как и характер сложного тела зависит от величины молекулы.
- Возможно открытие множества неизвестных миру элементов, таких как алюминий Al и кремний Si, которые имеют атомный вес 65 и 75 соответственно.
- Элемент иногда может менять свой атомный вес в соответствии со значениями своих соседних элементов. Например, атомный вес теллура (Te) может меняться от 123 до 126, но не может составлять 128.
- Атомная масса химического элемента позволяет определить определенные характерные свойства данного элемента.

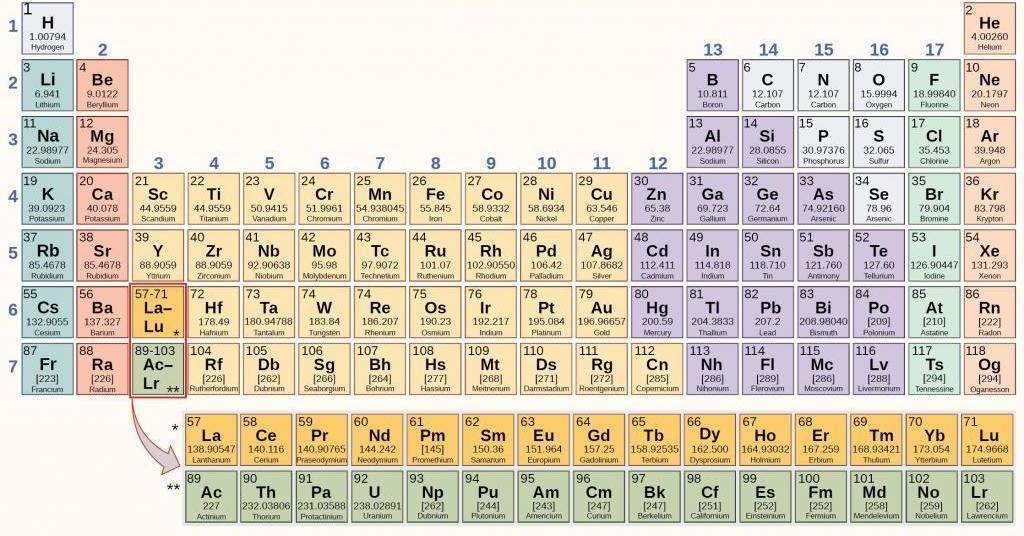
Периодическая таблица химических элементов
Периодическая таблица элементов является отображением открытия периодического закона Менделеева. Каждое число в таблице обозначает некоторую особенность в строении атома:
- На значение заряда атомного ядра влияет порядковый (атомный) номер элемента (значение протонов и электронов рядом с атомным ядром.
- Значение энергетического уровня (электронные слои) в атомах элементов выбранного периода совпадает с номером периода.
- Значение электронов внешнего уровня для элементов главных подгрупп и максимальное число валентных электронов для побочных подгрупп совпадает с номером группы.
Причиной периодичности элементов является перемена структуры наружных электронных слоев атома.
Из вышесказанного напрашивается некоторое заключение: свойства химических элементов и полученные из них вещества располагаются в периодической привязанности от структуры наружных электронных слоев атомов.
Современная периодическая таблица элементов
На сегодняшний день для группирования элементов возможно использование числа протонов в ядре взамен атомного. В таблице числится 120 элементов, расположенных слева направо в соответствии с увеличением атомного числа.
Столбцы таблицы обозначают собой группы, а строки – это периоды. Таблица включает в себя 18 групп и 8 периодов.
Металлические свойства элементов при перемещении по периоду в правую сторону снижаются, а в обратном – возрастают.
Величина атомов при движении направо продольно периоду уменьшается.
При смещении сверху вниз по группе возрастают восстановительные металлические свойства элементов.
Окислительные и неметаллические свойства при движении по периоду слева направо возрастают.
Заключение
Открытие периодического закона Менделеева дает возможность каждому химику предугадывать с определенной вероятностью свойства любого элемента перед работой с ним. Металлурги используют периодическую систему для изготовления новых сплавов, так как можно заменить один из металлов сплава другим, близким ему по свойствам. Это гарантирует незначительное изменение свойств получившегося сплава.
